Предмет: Химия,
автор: Аноним
Сколько моль гидроксида калия понадобится для получения 29,4 г гидроксида меди (II) при взаимодействии щелочи с раствором сульфата меди (II) CuSO4?
Ответы
Автор ответа:
6
Дано:
m(Cu(OH)2) = 29,4 г
Найти:
n(KOH)-?
M(Cu(OH)2) = 64+2*(16+1) = 98 г/моль
n(Cu(OH)2) = 29,4 г/98 г/моль = 0,3 моль
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
Из УХР n(KOH) = 2n(Cu(OH)2) = 2*0,3 моль = 0,6 моль
Ответ: 0,6 моль
m(Cu(OH)2) = 29,4 г
Найти:
n(KOH)-?
M(Cu(OH)2) = 64+2*(16+1) = 98 г/моль
n(Cu(OH)2) = 29,4 г/98 г/моль = 0,3 моль
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
Из УХР n(KOH) = 2n(Cu(OH)2) = 2*0,3 моль = 0,6 моль
Ответ: 0,6 моль
Автор ответа:
0
вроді так)))))))))))))
Приложения:
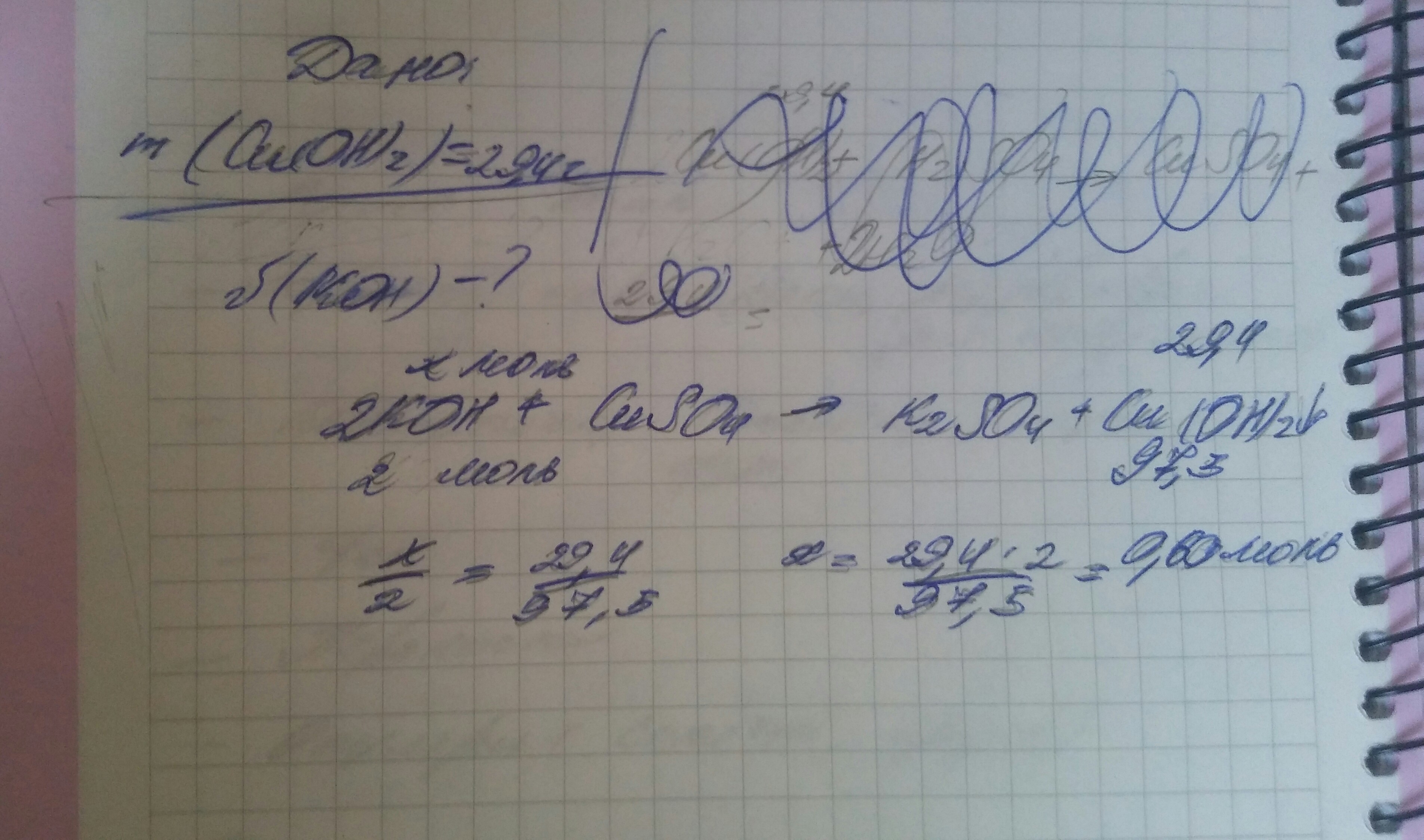
Похожие вопросы
Предмет: История,
автор: dreamer312
Предмет: Другие предметы,
автор: ilonazanizdra
Предмет: Алгебра,
автор: dimrj2008
Предмет: Математика,
автор: milanashorec
Предмет: Математика,
автор: лерочка40