Предмет: Химия,
автор: ReynardSir
1)Какой объем газа выделится при взаимодействии 300 грамм 10%-го раствора соляной кислоты с кусочком мрамора (карбоната кальция)
2)Какая масса осадка выпадет при взаимодействии 200грамм 40%-го раствора гидроксида натрия с раствором сульфата меди.
Ответы
Автор ответа:
0
CaCO3+2HCl=CaCl2+CO2+H2O
масса кислоты=300*0,1=30г
M(HCl)=36,5г/моль
количество кислоты n=m/M=30/36,5=0,82 моль
по уравнению реакции газа выделится в два раза меньше, т.е. 0,82/2=0,41 моль
объем газа=0,41*22,4=9,2л
2NaOH+CuSO4=Cu(OH)2+Na2SO4
M(NaOH)=40 г/моль
М(Cu(OH)2)=98 г/моль
масса гидроксида натрия в растворе=200*0,4=80г
количество гидроксида натрия 80/40=2 моль
гидроксида меди получается вдвое меньше, т.е 1 моль, т.е. 98 г
масса кислоты=300*0,1=30г
M(HCl)=36,5г/моль
количество кислоты n=m/M=30/36,5=0,82 моль
по уравнению реакции газа выделится в два раза меньше, т.е. 0,82/2=0,41 моль
объем газа=0,41*22,4=9,2л
2NaOH+CuSO4=Cu(OH)2+Na2SO4
M(NaOH)=40 г/моль
М(Cu(OH)2)=98 г/моль
масса гидроксида натрия в растворе=200*0,4=80г
количество гидроксида натрия 80/40=2 моль
гидроксида меди получается вдвое меньше, т.е 1 моль, т.е. 98 г
Автор ответа:
1
Вот правильный ответ, держи.
Приложения:
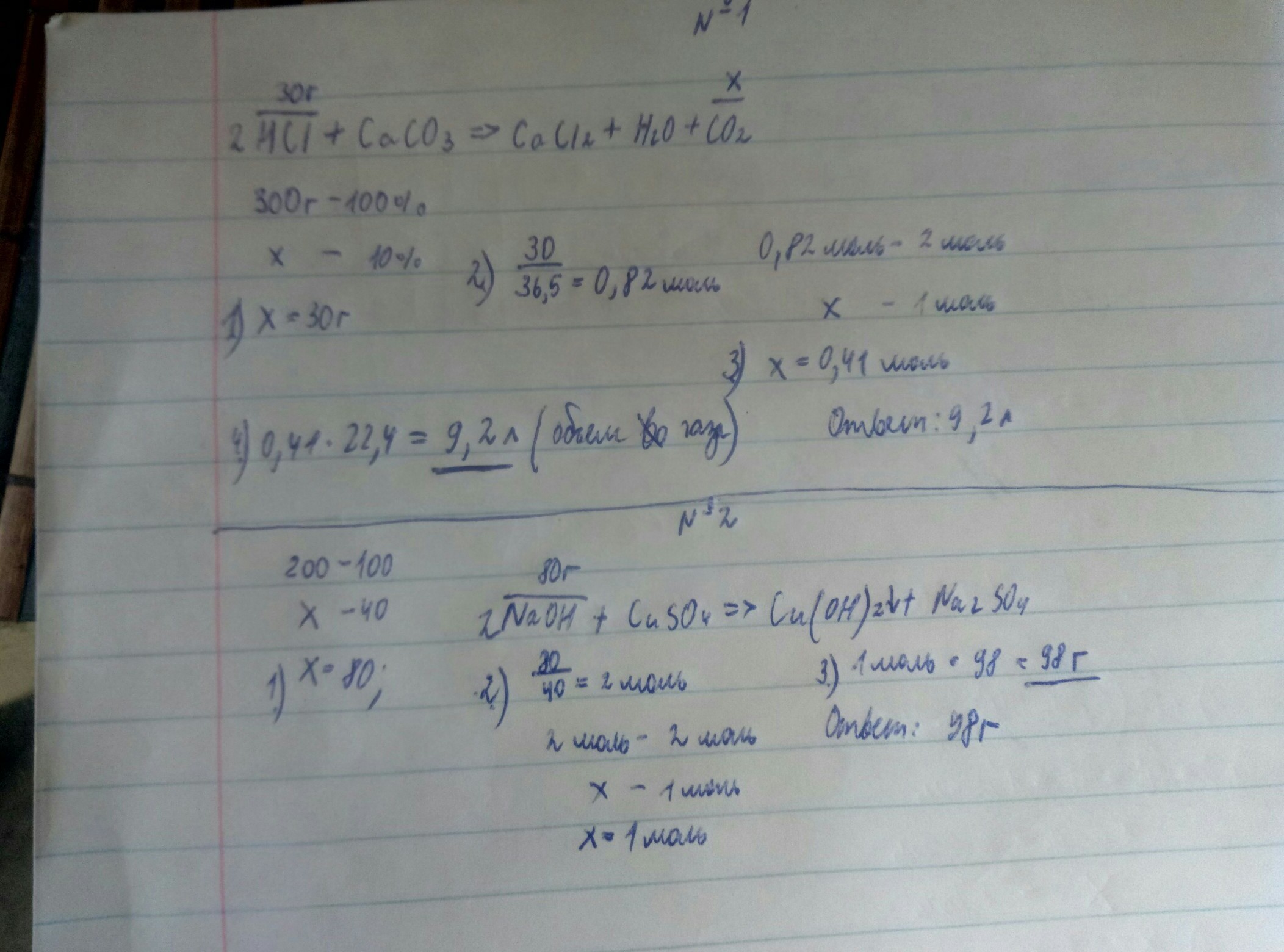
Похожие вопросы
Предмет: Беларуская мова,
автор: innaatrosenko53
Предмет: Русский язык,
автор: dfdfdfdf20
Предмет: ОБЖ,
автор: egor64696
Предмет: Математика,
автор: Sewka