Предмет: Химия,
автор: zeka505
Сколько граммов карбида алюминия получится при взаимодействии 108г алюминия и 108г углерода? Выход продукта составляет 50%. Ar(C)=12, Ar(Al)=27
Ответы
Автор ответа:
1
Ну нинаю...
4Al+3C→Al4C3
m(Al) = n*M = 4*27 = 108г
m(C) = n*M = 3*12 = 36г
m(Al4C3) = n*M = 1*(27*4+12*3) = 144г
n(C) = 108/12 = 9моль
n(Al) = 108/27 = 4моль
Al в недостатке.
108 - x
108 - 144
x = 144
(= Возможно неправильно, я не уверен в своем решении =)
4Al+3C→Al4C3
m(Al) = n*M = 4*27 = 108г
m(C) = n*M = 3*12 = 36г
m(Al4C3) = n*M = 1*(27*4+12*3) = 144г
n(C) = 108/12 = 9моль
n(Al) = 108/27 = 4моль
Al в недостатке.
108 - x
108 - 144
x = 144
(= Возможно неправильно, я не уверен в своем решении =)
Автор ответа:
3
.............................
Приложения:
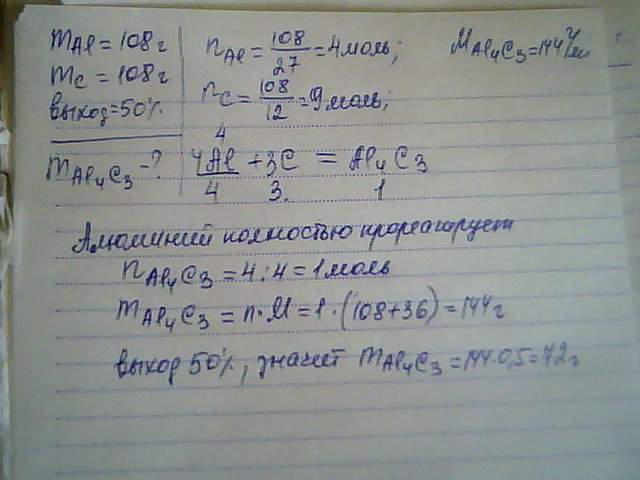
Похожие вопросы
Предмет: Українська мова,
автор: oksanadudar05461
Предмет: Математика,
автор: kcehuabau2567
Предмет: Математика,
автор: gandjayevagulchehra
Предмет: Математика,
автор: Sprinter149
Предмет: Алгебра,
автор: kollachilli