Предмет: Химия,
автор: lilkidflucky
Какой объем аммиака образуется при взаимодействии 535 г 20%-го раствора хлорида аммония с гидроксидом калия.
Ответы
Автор ответа:
2
Решение в прикрепленной фотографии.
Приложения:
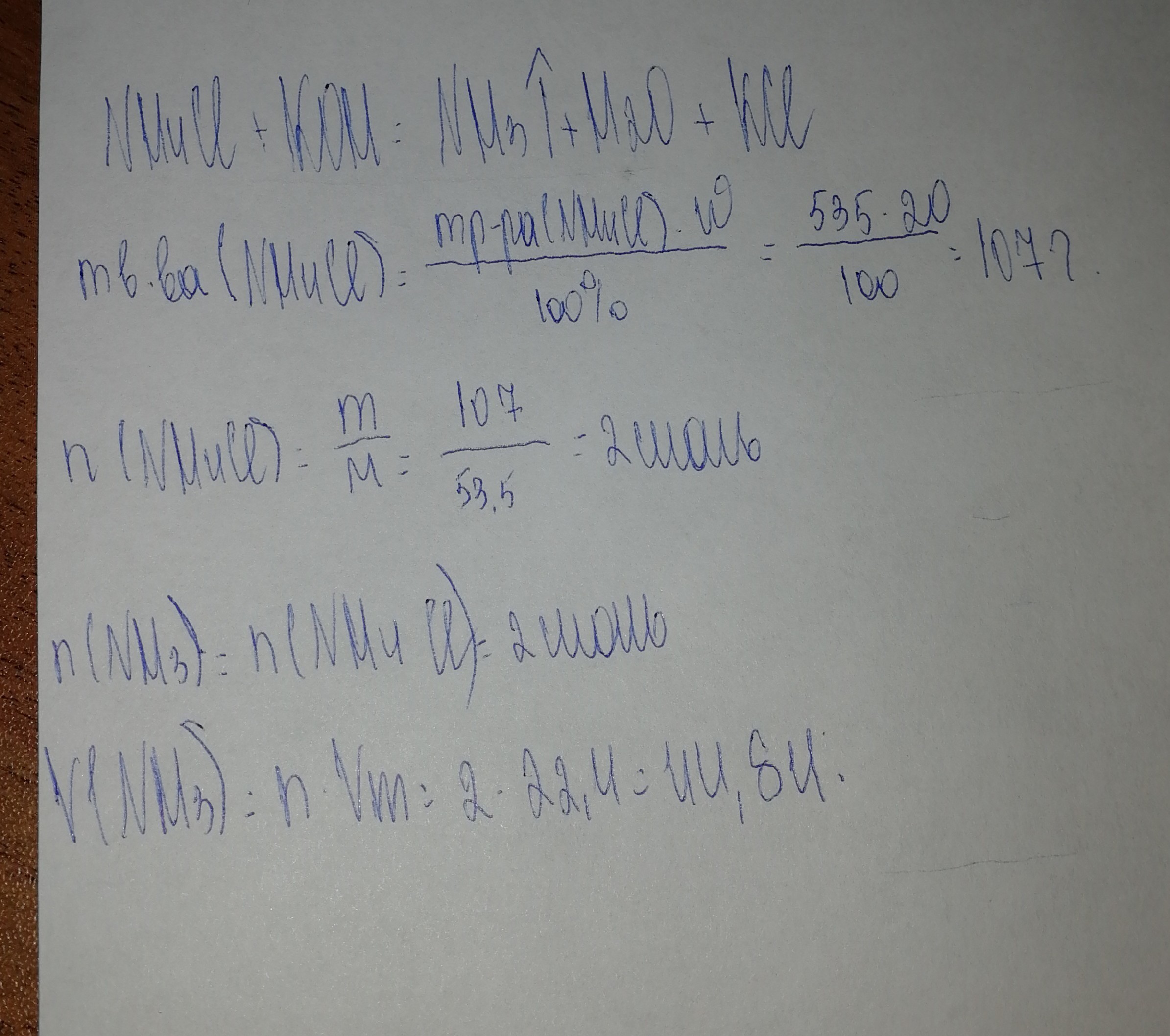
Автор ответа:
7
Дано:
m(p-pa NH4Cl) = 535 r
ω(NH4Cl) = 20% или 0,2
Найти:
V(NH3)-?
Решение.
M(NH4Cl) = 53,5 г/моль
m(NH4Cl) = m(p-paNH4Cl)*ω(NH4Cl) = 535 г*0,2 = 107 г
n(NH4Cl) = m/M = 107 г/53,5 г/моль = 2 моль
Vm = 22,4 л/моль
NH4Cl + KOH = KCl + NH3↑ + H2O
Из УХР следует, что n(NH3)=n(NH4Cl)
n(NH3)=2 моль
V(NH3)=n*Vm = 2 моль*22,4 л/моль = 44,8 л
Ответ: 44,8 л
m(p-pa NH4Cl) = 535 r
ω(NH4Cl) = 20% или 0,2
Найти:
V(NH3)-?
Решение.
M(NH4Cl) = 53,5 г/моль
m(NH4Cl) = m(p-paNH4Cl)*ω(NH4Cl) = 535 г*0,2 = 107 г
n(NH4Cl) = m/M = 107 г/53,5 г/моль = 2 моль
Vm = 22,4 л/моль
NH4Cl + KOH = KCl + NH3↑ + H2O
Из УХР следует, что n(NH3)=n(NH4Cl)
n(NH3)=2 моль
V(NH3)=n*Vm = 2 моль*22,4 л/моль = 44,8 л
Ответ: 44,8 л
Похожие вопросы
Предмет: Алгебра,
автор: Erasyl2005
Предмет: Английский язык,
автор: Gamer2009
Предмет: Математика,
автор: kisha228
Предмет: Алгебра,
автор: alexeygytnik