Предмет: Химия,
автор: Leviseee
Срочно даю 67 баллов! - Раствор силиката калия массой 201 г слили с избытком разбавленной азотной кислоты. Масса полученного осадка составила 23,4 г. Рассчитайте массовую долю соли в исходном растворе.
P.S: Распишите все пожалуйста по действиям и что мы находим последовательно.
Ответы
Автор ответа:
1
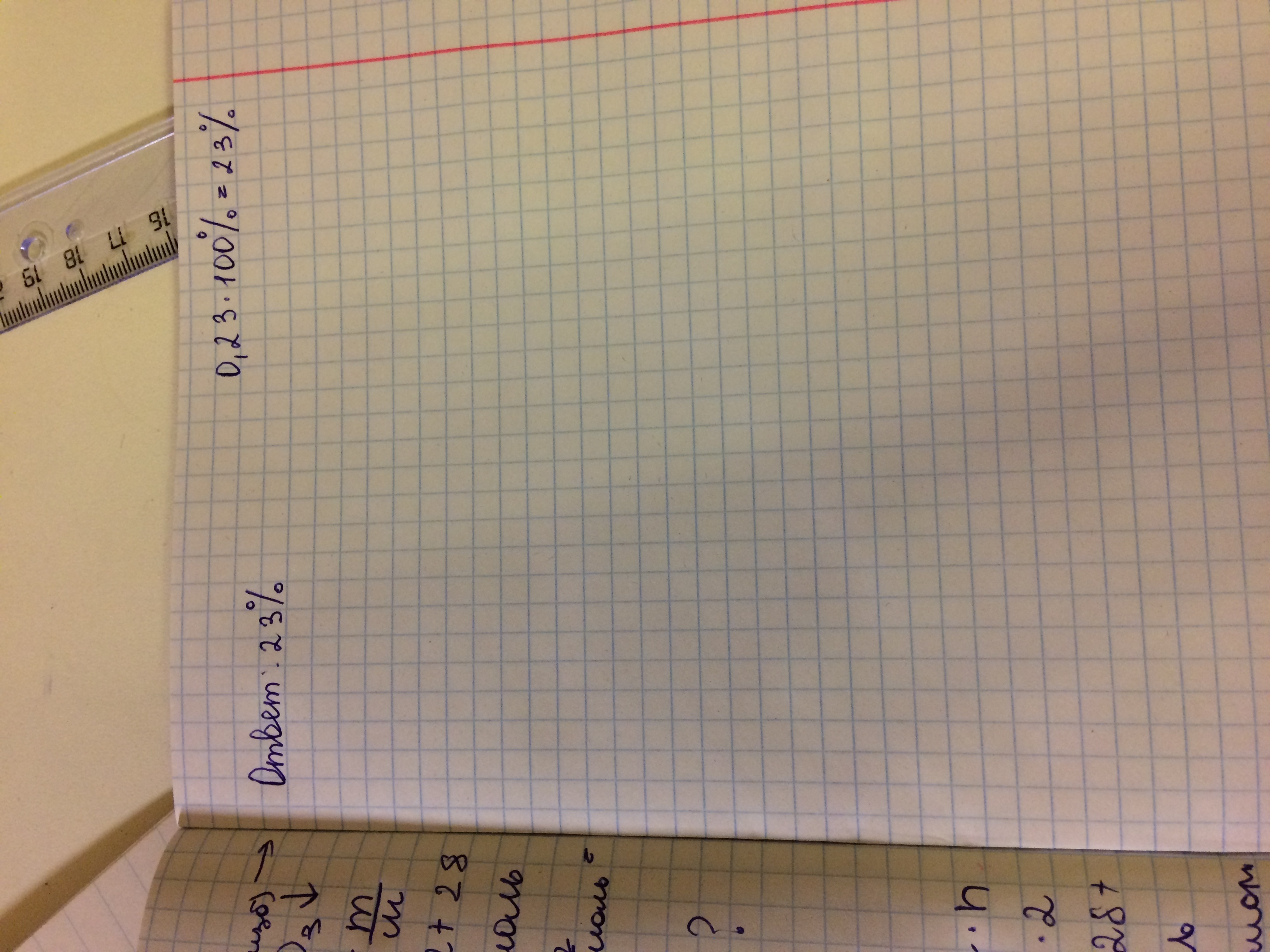
Расписала все по пунктам,как и просили
Приложения:

Leviseee:
Благодарю, ответ верный.
Автор ответа:
0
1) Уравнение реакции:
K2SiO3 + 2HNO3 = 2KNO3 + H2SiO3
в осадок выпадает H2SiO3 (см. таблицу растворимости кислот, солей и оснований в воде)
2) Рассчитываем молярные массы:
- силикат калия M(K2SiO3) = 2*39 + 28 +3*16 = 154 г/моль
- кремниевая (или силикатная) кислота M(H2SiO3) = 2*1 + 28 + 3*16 = 78 г/моль
3) По ур-ию реакции составляем пропорцию:
154 г K2SiO3 образуют 78 г H2SiO3 (осадка)
201 г K2SiO3 ------------- Х г H2SiO3
X = 201*78/154 = 101,8 г осадка - это теоретический выход
4) Рассчитываем массовую долю соли (K2SiO3) в исходном растворе:
101,8 г ---------- 100%
23,4 г -------------Х% Х = 23,4*100/101,8 = 22,98%
K2SiO3 + 2HNO3 = 2KNO3 + H2SiO3
в осадок выпадает H2SiO3 (см. таблицу растворимости кислот, солей и оснований в воде)
2) Рассчитываем молярные массы:
- силикат калия M(K2SiO3) = 2*39 + 28 +3*16 = 154 г/моль
- кремниевая (или силикатная) кислота M(H2SiO3) = 2*1 + 28 + 3*16 = 78 г/моль
3) По ур-ию реакции составляем пропорцию:
154 г K2SiO3 образуют 78 г H2SiO3 (осадка)
201 г K2SiO3 ------------- Х г H2SiO3
X = 201*78/154 = 101,8 г осадка - это теоретический выход
4) Рассчитываем массовую долю соли (K2SiO3) в исходном растворе:
101,8 г ---------- 100%
23,4 г -------------Х% Х = 23,4*100/101,8 = 22,98%
Похожие вопросы
Предмет: Математика,
автор: sanekfrrtt
Предмет: География,
автор: LiMon4ki
Предмет: Математика,
автор: kassmnur
Предмет: Алгебра,
автор: Catty19