Предмет: Химия,
автор: qasimov2772
При сжигании 8 г серы (S) в кислороде образуется SO2 с выходом 75%. Вычислите массу (в граммах) продукта.
Ответы
Автор ответа:
14
Решение в прикрепленной фотографии.
Приложения:
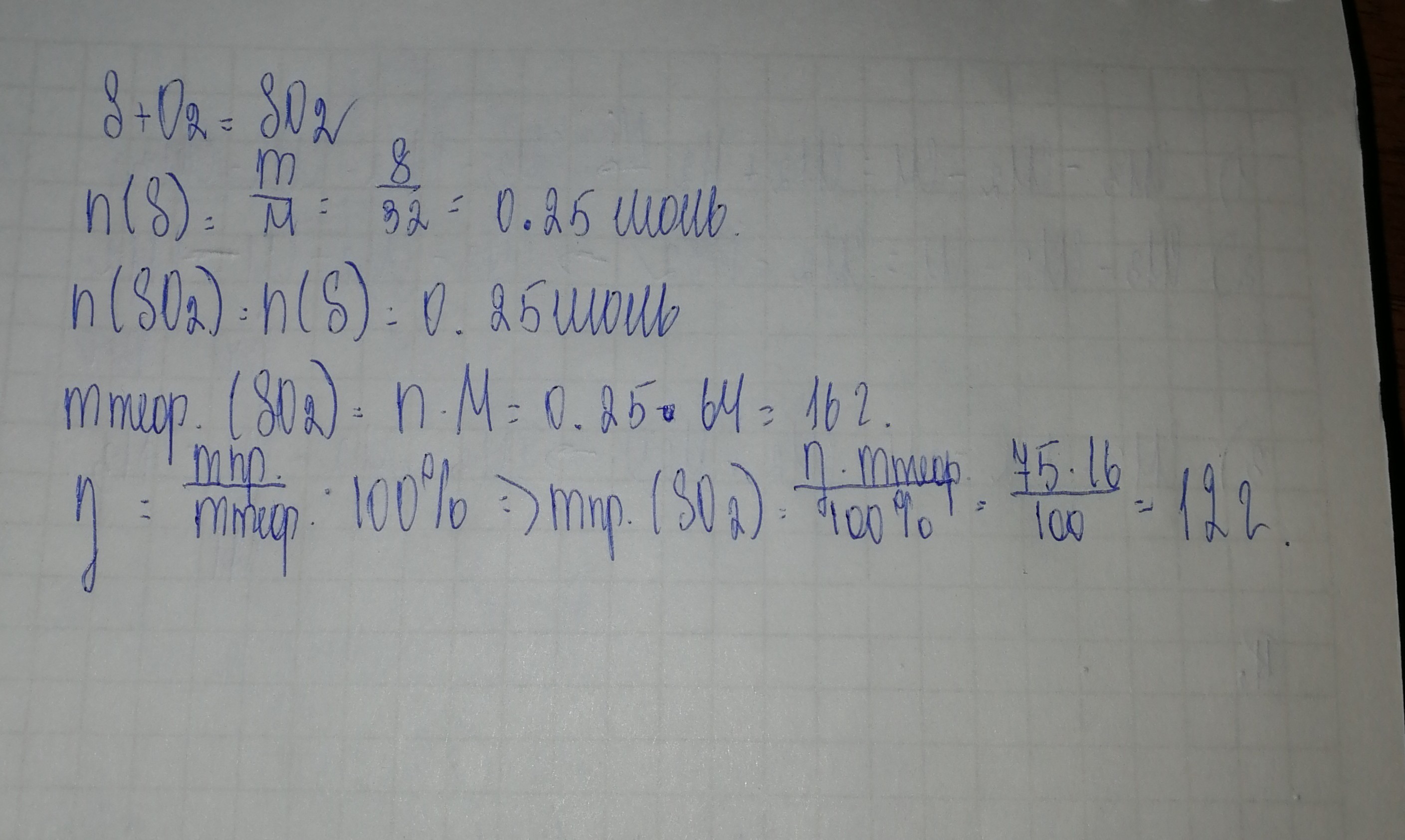
Автор ответа:
11
Дано:
m(S) = 8 г
η(SO2) = 75% или 0,75
Найти:
m(SO2)-?
Решение.
M(S) = 32 г/моль
n(S) = m/M = 8 г/32 г/моль = 0,25 моль
M(SO2) = 64 г/моль
S+O2 = SO2
Из УХР следует, что n(SO2)=n(S)
n(теор.SO2) = 0,25 моль
n(пр.SO2)= n(теор.SO2)*η(SO2) = 0,25 моль*0,75 = 0,1875 моль
m(SO2) = n(пр.SO2)*M(SO2) = 0,1875 моль*64 г/моль = 12 г
Ответ: 12 г
m(S) = 8 г
η(SO2) = 75% или 0,75
Найти:
m(SO2)-?
Решение.
M(S) = 32 г/моль
n(S) = m/M = 8 г/32 г/моль = 0,25 моль
M(SO2) = 64 г/моль
S+O2 = SO2
Из УХР следует, что n(SO2)=n(S)
n(теор.SO2) = 0,25 моль
n(пр.SO2)= n(теор.SO2)*η(SO2) = 0,25 моль*0,75 = 0,1875 моль
m(SO2) = n(пр.SO2)*M(SO2) = 0,1875 моль*64 г/моль = 12 г
Ответ: 12 г
Похожие вопросы
Предмет: Математика,
автор: bebra3322
Предмет: Математика,
автор: sofiamatin2020
Предмет: Другие предметы,
автор: koptevam2010
Предмет: Математика,
автор: sabekiyadana