Предмет: Химия,
автор: лара2003
Используя метод электронного баланса Расставьте степени окисления, Укажите окислитель и восстановитель Расставьте коэффициенты.
Cu+HNO3=Cu(NO3)2+NO+H2O
Приложения:
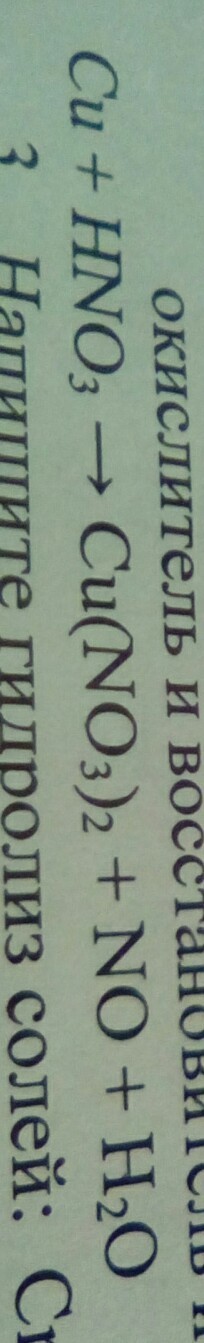
Ответы
Автор ответа:
0
Cu(0)+H(+1)N(+5)O3(-2)=Cu(+2)(N(+5)O3(-2)+N(+2)O(-2)+H2(+1)O(-2)
- в скобках со знаками их с.о
Сu(O) - 2e = Cu(2+) /2/3 восстановитель, р. окисление
N(+5) +3e = N(+2) /3/2 окислитель, р восстановление
3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2 NO + 4 H2O
- в скобках со знаками их с.о
Сu(O) - 2e = Cu(2+) /2/3 восстановитель, р. окисление
N(+5) +3e = N(+2) /3/2 окислитель, р восстановление
3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2 NO + 4 H2O
Автор ответа:
0
спасибо)
Похожие вопросы
Предмет: Русский язык,
автор: nazifematevosan
Предмет: Геометрия,
автор: aroslavkruglov838
Предмет: Математика,
автор: sabina3999
Предмет: Алгебра,
автор: olik1009
Предмет: Математика,
автор: alexandrovka