Предмет: Химия,
автор: Иван199928
99 БАЛЛОВ! + ВЫБЕРУ ЛУЧШИМ.
К раствору содержащему 10 г H2SO4 прибавили 9 г. NAOH. Какую реакцию имеет раствор - кислую, нейтральную или щелочную? Доказательство
Ответы
Автор ответа:
0
Решение заключается в том,чтобы найти что в избытке,а что в недостатке.Смотри на фото
Приложения:
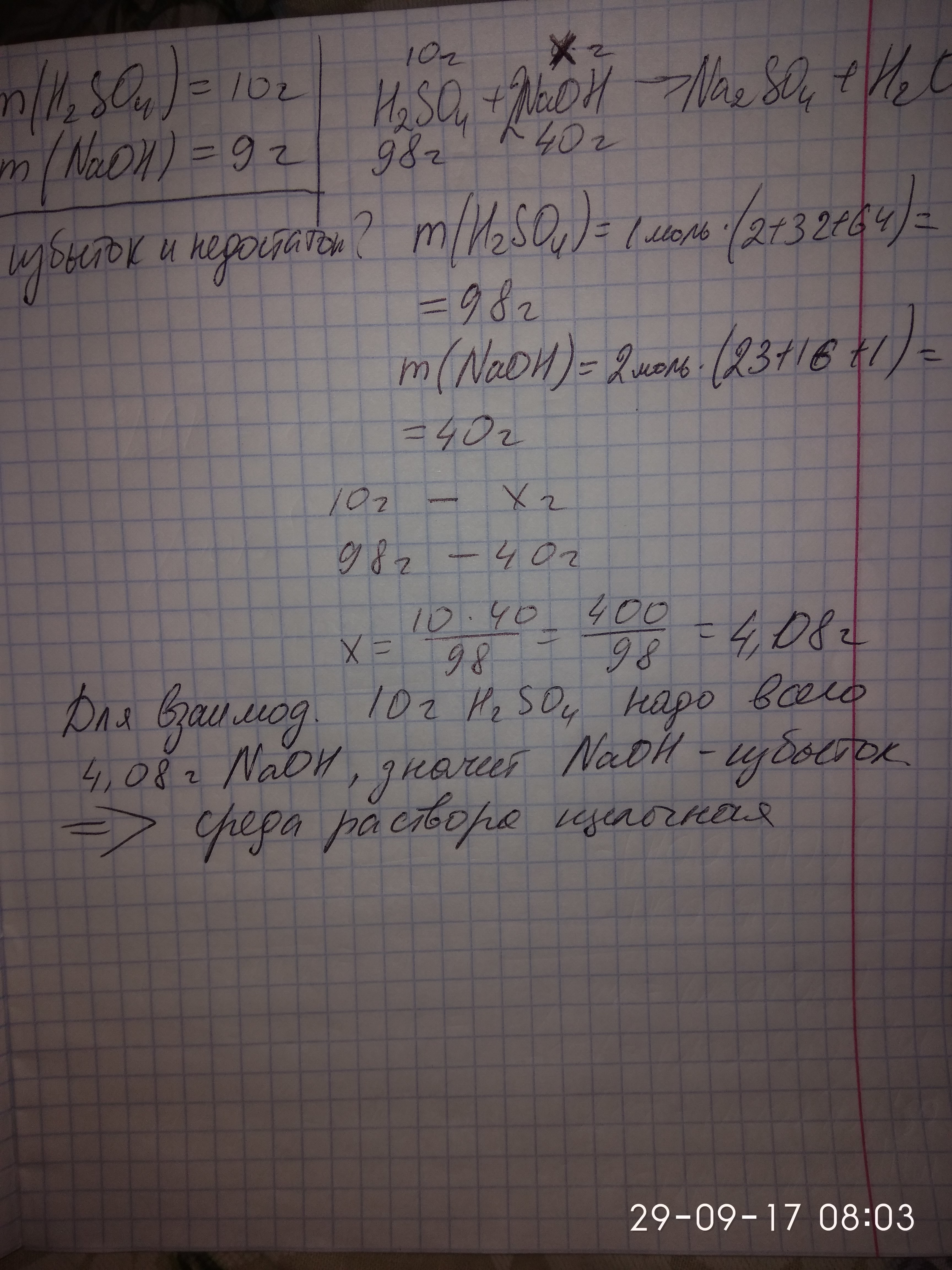
Автор ответа:
0
Дано:
m(H2SO4) = 10 r
m(NaOH) = 9 r
Найти:
среда р-ра-?
M(H2SO4) = 98 г/моль
n(H2SO4) = m/M = 10 г/98 г/моль = 0,1 моль
M(NaOH) = 40 г/моль
n(NaOH) = m/M = 9 г/40 г/моль = 0,225 моль
Н2SO4 + 2NaOH = Na2SO4 + 2H2O
Из УХР следует, что n(H2SO4):n(NaOH) =1:2
Из расчетов по условию задачи
n(H2SO4):n(NaOH) = 0.1:0.225 == 1:2.25.
то есть NaOH взят в избытке.
Поэтому полученный раствор будет иметь щелочную
m(H2SO4) = 10 r
m(NaOH) = 9 r
Найти:
среда р-ра-?
M(H2SO4) = 98 г/моль
n(H2SO4) = m/M = 10 г/98 г/моль = 0,1 моль
M(NaOH) = 40 г/моль
n(NaOH) = m/M = 9 г/40 г/моль = 0,225 моль
Н2SO4 + 2NaOH = Na2SO4 + 2H2O
Из УХР следует, что n(H2SO4):n(NaOH) =1:2
Из расчетов по условию задачи
n(H2SO4):n(NaOH) = 0.1:0.225 == 1:2.25.
то есть NaOH взят в избытке.
Поэтому полученный раствор будет иметь щелочную
Приложения:
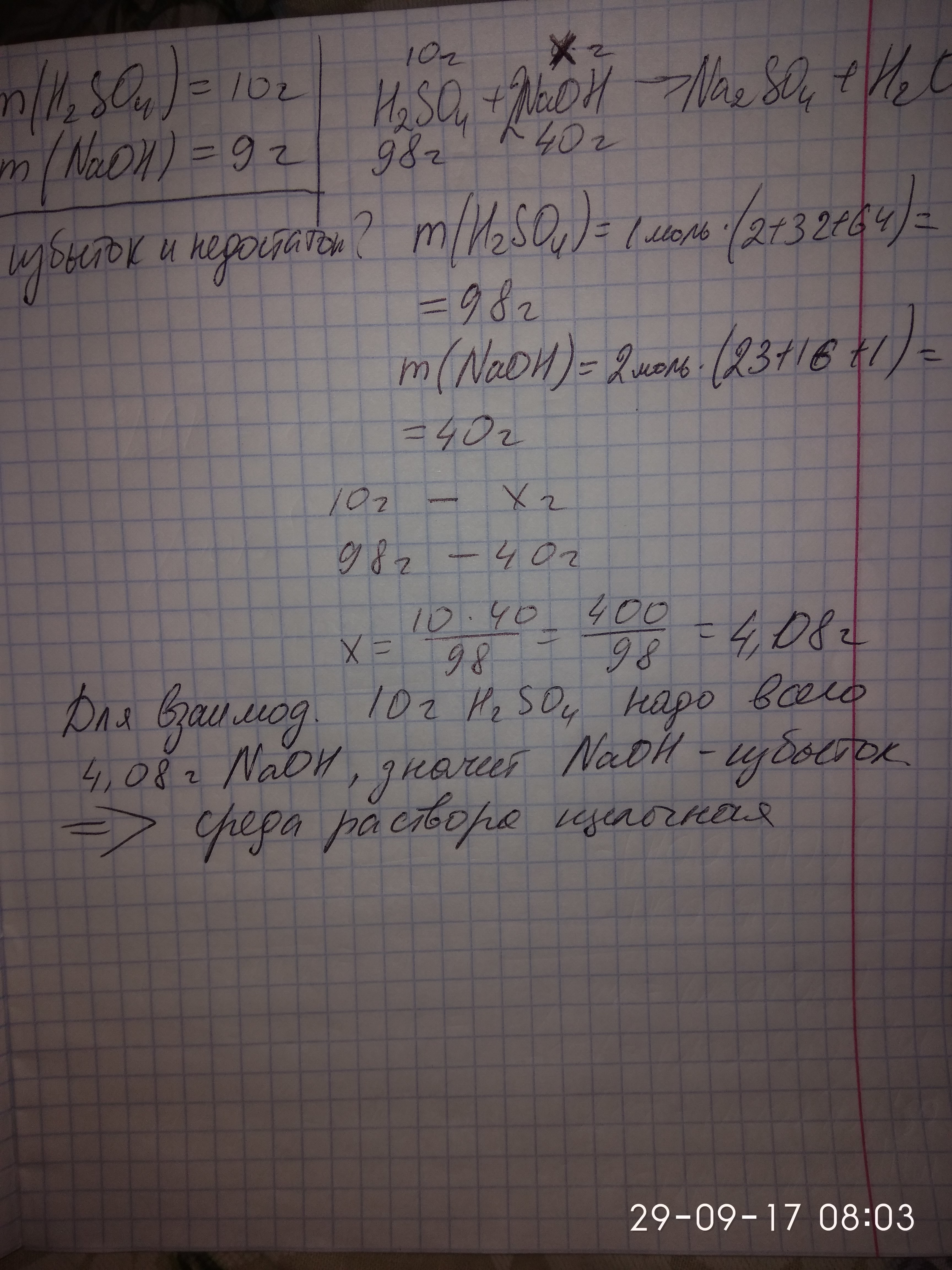
Похожие вопросы
Предмет: Алгебра,
автор: ROMA1b
Предмет: Русский язык,
автор: mangobitch
Предмет: Математика,
автор: esinadara21
Предмет: География,
автор: 123993
Предмет: Математика,
автор: polina32154