Предмет: Химия,
автор: Svetik02
Помогите пожалуйста,правильно ли я делаю, постоянно на этом месте путаюсь
Определите растворимость соли Ag3PO4 в моль/л и г/л, если ПР Ag3PO4 = 1,8 х 10 -16.
Приложения:
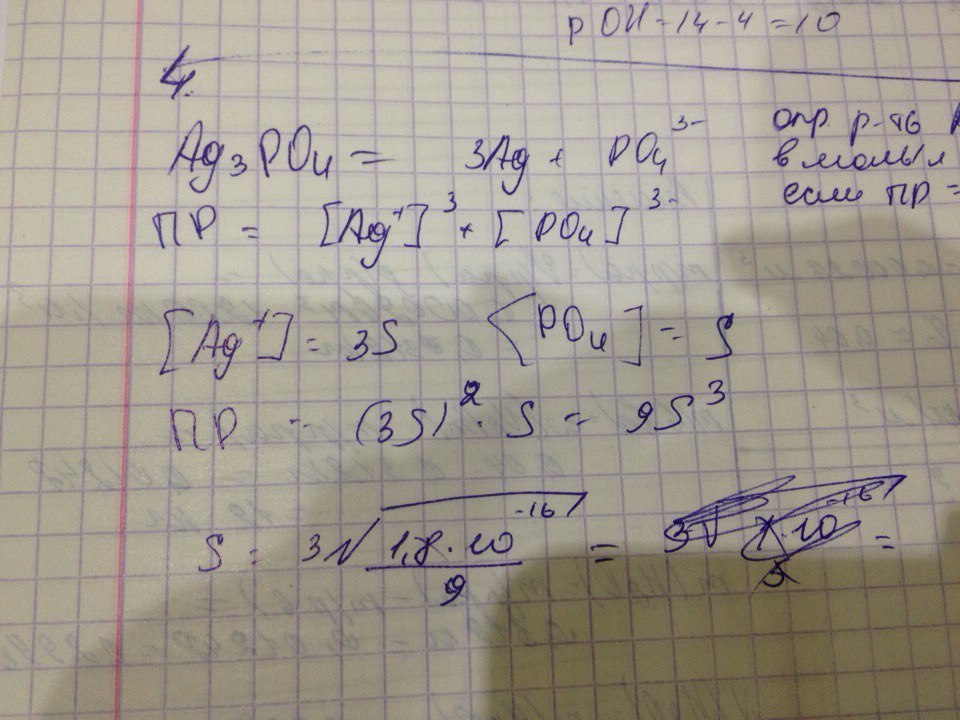
Ответы
Автор ответа:
0
Дано: ПР(Ag₃PO₄) = 1,8*10⁻¹⁶
Найти: S(моль/л) и S(г/л)
Решение:
Диссоциация соли: Ag₃PO₄ ⇄ 3Ag⁺ + PO₄³⁻
ПР(Ag₃PO₄) = [Ag⁺]³ * [PO₄³⁻] = 1,8*10⁻¹⁶
Согласно уравнению диссоциации ионов серебра образуется при распаде одного моля соли в 3 раза больше, чем фосфат-ионов. т.е.
[Ag⁺] = 3[PO₄³⁻]
Заменим в формуле ПР концентрацию ионов серебра на выраженную через концентрацию фосфат-ион величину:
[3PO₄³⁻]³ * [PO₄³⁻] = 1,8*10⁻¹⁶
27[PO₄³⁻]³ * [PO₄³⁻] = 1,8*10⁻¹⁶
[PO₄³⁻]⁴ = (1,8/27)*10⁻¹⁶ = 0,0(6)*10⁻¹⁶
[PO₄³⁻] = √[√0,0(6)*10⁻¹⁶] ≈ 0,508*10⁻⁴ = 5,08*10⁻⁵ (моль/л)
По уравнению диссоциации число молей фосфат-ионов равно числу молей продиссоциировавшей соли, т.е. ее растворимость 5,08*10⁻⁵ моль/л
Молярная масса фосфата серебра:
М(Ag₃PO₄) = 108*3+31+10*4 = 419 (г/моль)
S(Ag₃PO₄) = 419*5,08*10⁻⁵ ≈ 0,0213 ≈ 0,02 (г/л)
Ответ: 5*10⁻⁵ моль/л, 0,02 г/л
Примечание. Растворимость обычно выражается количеством вещества, растворенного в 100 г воды. При такой малой концентрации плотность насыщенного раствора будет близка к плотности воды и S=0,002г(Ag₃PO₄)/100г(Н₂О)
Найти: S(моль/л) и S(г/л)
Решение:
Диссоциация соли: Ag₃PO₄ ⇄ 3Ag⁺ + PO₄³⁻
ПР(Ag₃PO₄) = [Ag⁺]³ * [PO₄³⁻] = 1,8*10⁻¹⁶
Согласно уравнению диссоциации ионов серебра образуется при распаде одного моля соли в 3 раза больше, чем фосфат-ионов. т.е.
[Ag⁺] = 3[PO₄³⁻]
Заменим в формуле ПР концентрацию ионов серебра на выраженную через концентрацию фосфат-ион величину:
[3PO₄³⁻]³ * [PO₄³⁻] = 1,8*10⁻¹⁶
27[PO₄³⁻]³ * [PO₄³⁻] = 1,8*10⁻¹⁶
[PO₄³⁻]⁴ = (1,8/27)*10⁻¹⁶ = 0,0(6)*10⁻¹⁶
[PO₄³⁻] = √[√0,0(6)*10⁻¹⁶] ≈ 0,508*10⁻⁴ = 5,08*10⁻⁵ (моль/л)
По уравнению диссоциации число молей фосфат-ионов равно числу молей продиссоциировавшей соли, т.е. ее растворимость 5,08*10⁻⁵ моль/л
Молярная масса фосфата серебра:
М(Ag₃PO₄) = 108*3+31+10*4 = 419 (г/моль)
S(Ag₃PO₄) = 419*5,08*10⁻⁵ ≈ 0,0213 ≈ 0,02 (г/л)
Ответ: 5*10⁻⁵ моль/л, 0,02 г/л
Примечание. Растворимость обычно выражается количеством вещества, растворенного в 100 г воды. При такой малой концентрации плотность насыщенного раствора будет близка к плотности воды и S=0,002г(Ag₃PO₄)/100г(Н₂О)
Похожие вопросы
Предмет: Русский язык,
автор: bimonakimova
Предмет: Алгебра,
автор: rlorgi
Предмет: Математика,
автор: bianabelaeva9998
Предмет: Биология,
автор: albuz