Предмет: Химия,
автор: spammy
Рассчитать объем водорода, получившегося при взаимодействии металлического натрия с разбавленной серной кислотой, если в реакции участвовало 4.9 грамм кислоты.
Ответы
Автор ответа:
0
смотри уравнение реакции на фотографии
масса кислоты 4,9 грамм. найдем количество кислоты
n = m/M = 4,9 / (2+32+64) = 0,05 моль.
Количество водорода равно количеству кислоты, так как коэффициенты в реакции 1:1.
Тогда объем водорода найдем по формуле: V = n* Vm = 22,4 * 0,05 = 1,12 л.
Ответ: 1,12 л.
масса кислоты 4,9 грамм. найдем количество кислоты
n = m/M = 4,9 / (2+32+64) = 0,05 моль.
Количество водорода равно количеству кислоты, так как коэффициенты в реакции 1:1.
Тогда объем водорода найдем по формуле: V = n* Vm = 22,4 * 0,05 = 1,12 л.
Ответ: 1,12 л.
Приложения:
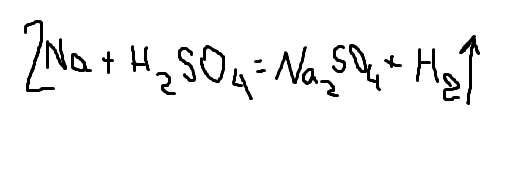
Похожие вопросы