Предмет: Химия,
автор: hotnerd
Подскажите пожалуйста как в этой задаче (решение прикреплено):Сколько граммов хлора потребуется при взаимодействии с алюминием массой 5,4 г?
появилось 54 г и 213 г ?
Приложения:
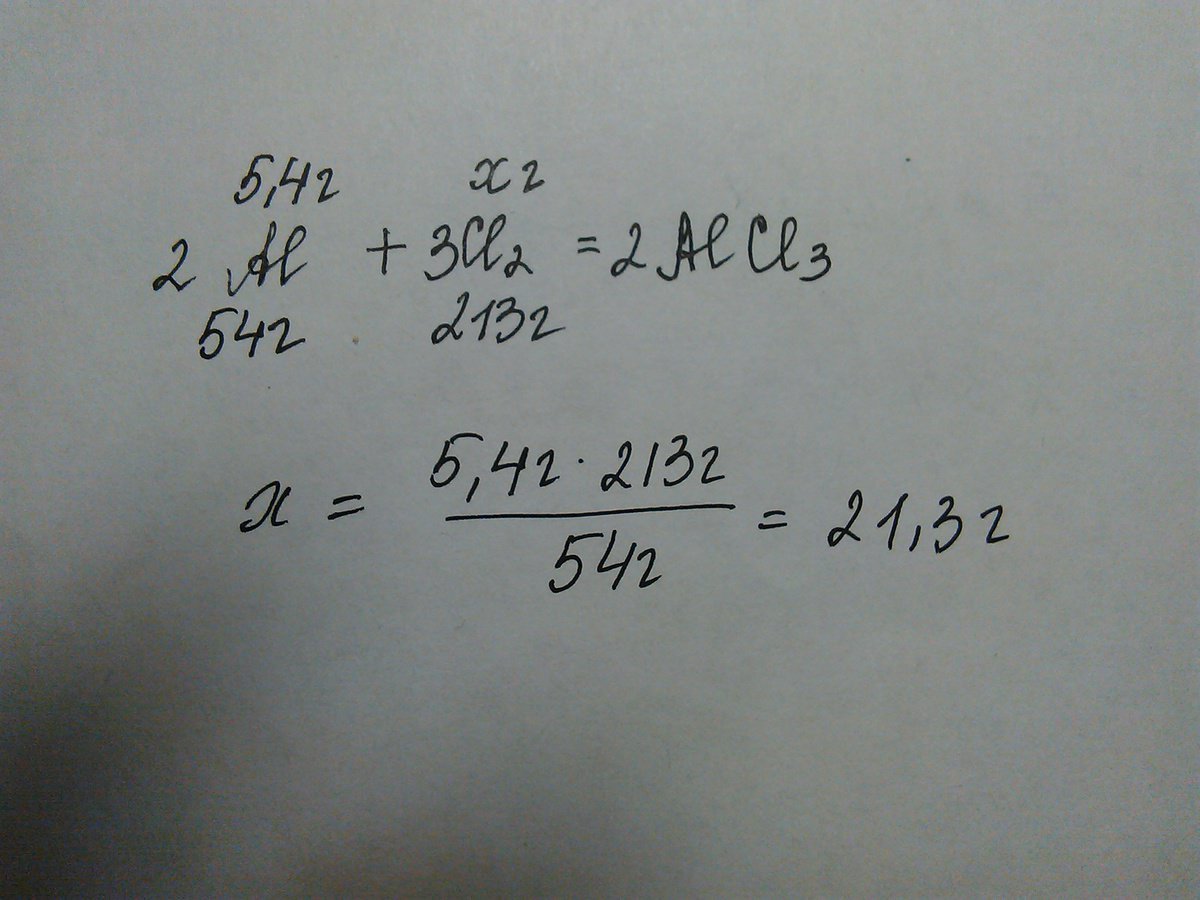
Ответы
Автор ответа:
0
Дано:
m(Al) = 5.4 г
Найти:
m(Cl2) =?
Решение.
M(Al) = 27 г/моль
M(Cl2) = 35,5*2 = 71 г/моль
5,4 г х г
2Al + 3Cl2 = 2AlCl3
2 моль 3 моль
27 г/моль 71 г/моль
54 г 213 г
(2*27) (3*71)
5,4/54=х/71
х=m(Cl2) = 21.3 г
Ответ: 21,3 г
m(Al) = 5.4 г
Найти:
m(Cl2) =?
Решение.
M(Al) = 27 г/моль
M(Cl2) = 35,5*2 = 71 г/моль
5,4 г х г
2Al + 3Cl2 = 2AlCl3
2 моль 3 моль
27 г/моль 71 г/моль
54 г 213 г
(2*27) (3*71)
5,4/54=х/71
х=m(Cl2) = 21.3 г
Ответ: 21,3 г
Автор ответа:
0
Это молярные массы .У алюминия относ атомная масса 27 умножается на
коэффициент2
М(CI2)35,5*2=71
71*3(коэффициент перед хлором)=213
коэффициент2
М(CI2)35,5*2=71
71*3(коэффициент перед хлором)=213
Похожие вопросы
Предмет: Литература,
автор: aleksejcoj042010
Предмет: Математика,
автор: MadaliZamirov
Предмет: Химия,
автор: paulelkin2006
Предмет: Алгебра,
автор: BangBangBang
Предмет: Литература,
автор: rokhlovamasha