Предмет: Химия,
автор: lososcherepaha
сколько граммов пятнадцатипроцентной H2SO4 необходимо для растворения 9,6 граммов Fe2O3 ?
Ответы
Автор ответа:
0
у меня там ошибка не246,а 294
так что 100%-17.64
15%-2,6
так что 100%-17.64
15%-2,6
Приложения:
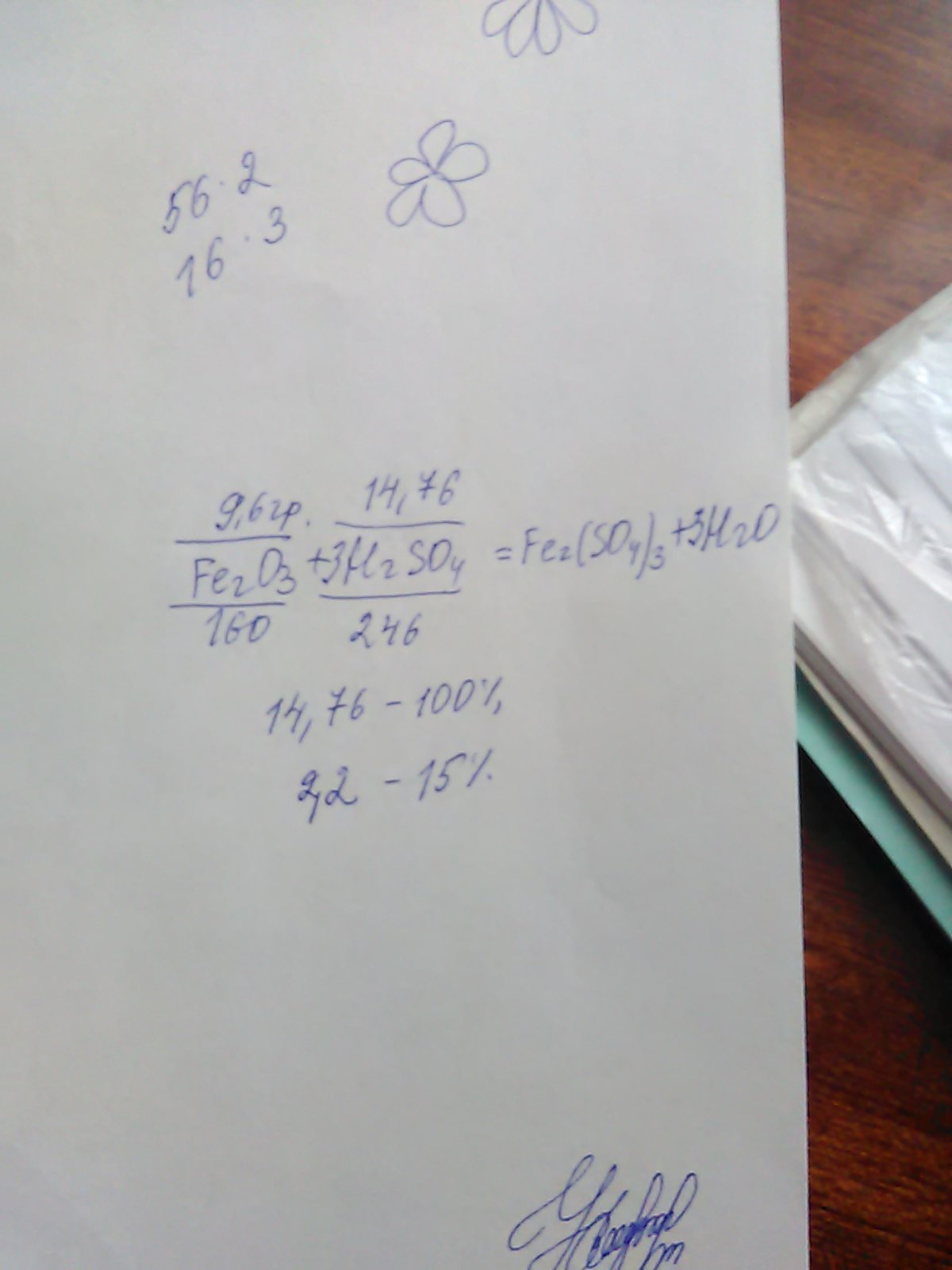
Автор ответа:
0
спасибо!!
Автор ответа:
0
Xg 9.6 g
3H2SO4+Fe2O3-->3H2O+Fe2(SO4)3
3*98 160
M(H2SO4)=98 g/mol M(Fe2O3)=160 g/mol
x/294 = 9.6 / 160
X=17.64 g
m(ppa)=17.64*100%/15%=117.6g
ответ 117.6 г
3H2SO4+Fe2O3-->3H2O+Fe2(SO4)3
3*98 160
M(H2SO4)=98 g/mol M(Fe2O3)=160 g/mol
x/294 = 9.6 / 160
X=17.64 g
m(ppa)=17.64*100%/15%=117.6g
ответ 117.6 г
Приложения:
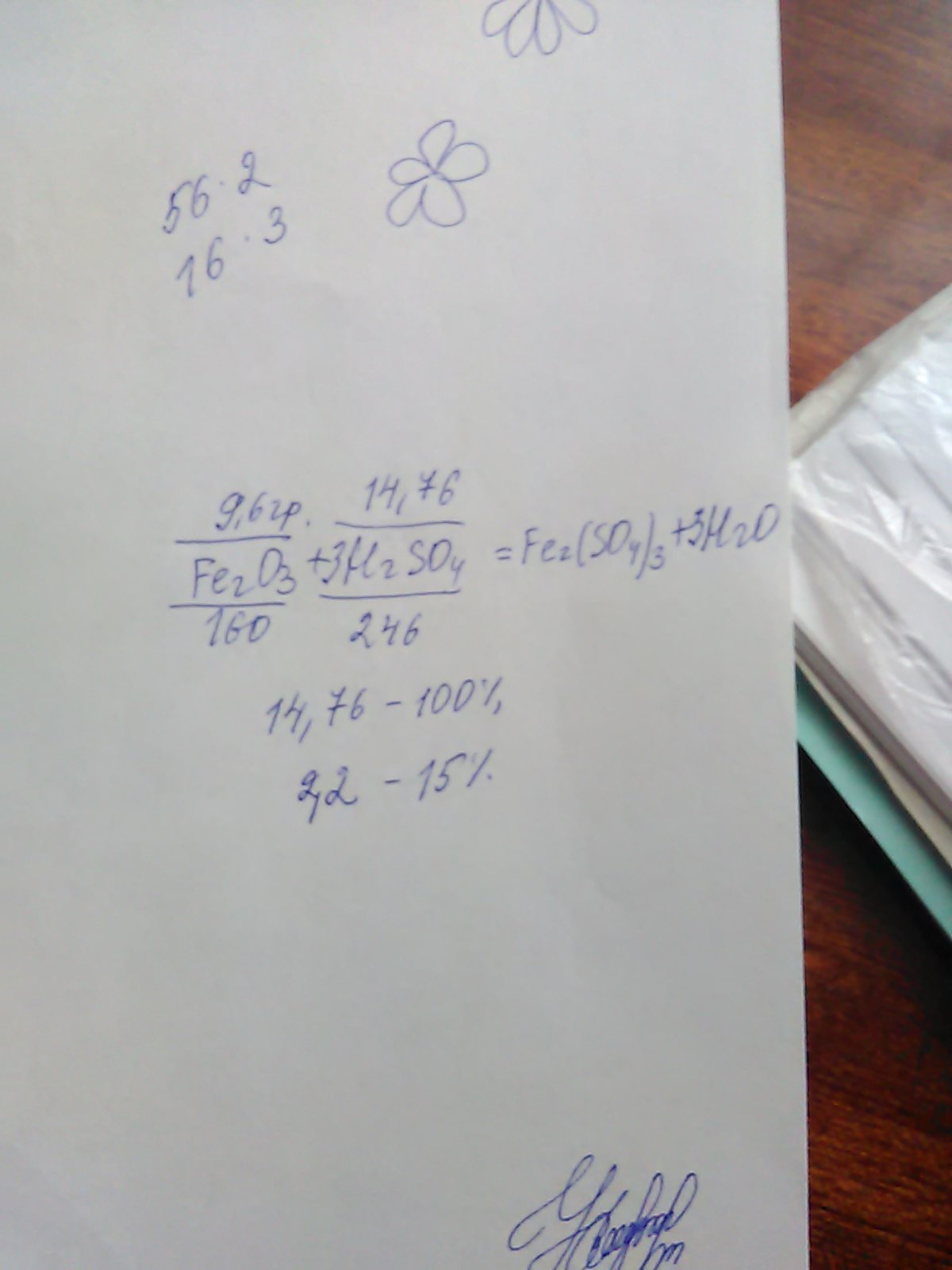
Автор ответа:
0
спасибо большое!!
Похожие вопросы
Предмет: Геометрия,
автор: Vsevporadke
Предмет: Математика,
автор: wuzzywuzzy765
Предмет: Английский язык,
автор: 06polina227
Предмет: Алгебра,
автор: ЗлАтКа17
Предмет: Алгебра,
автор: Goodfray