Предмет: Химия,
автор: Li808
Какой объём углекислого газа (CO2) выделиться при прокаливании 500 грамм известняка содержащего 20 % примесей. С объяснением пожалуйста!!!
Ответы
Автор ответа:
0
Всё написано в картинке
Приложения:
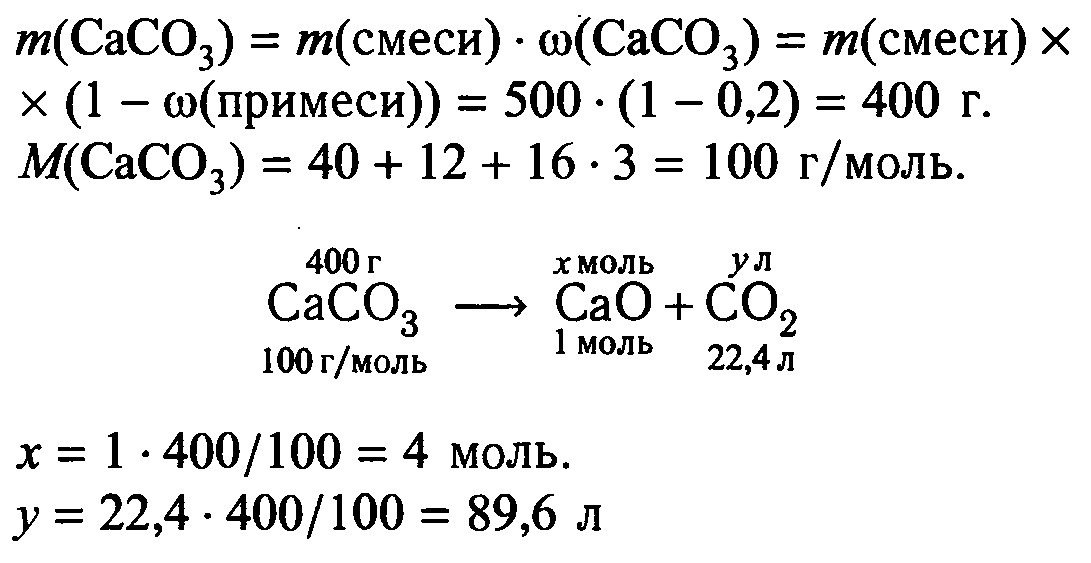
Автор ответа:
0
Дано:
mр-р(CaCO3) = 500г
w(примеси) = 20 %
Найти:
V(CO2) - ?
Решение:
CaCO3 = CaO + CO2
w(CaCO3) = 100% - 20% = 80%
m(CaCO3) = 500 г * 0,8 = 400 г
n(CaCO3) = 400 г / 100 г/моль = 4 моль
n(CO2) = n(CaCO3) = 4 моль
V(CO2) = 4 моль * 22,4 л/моль = 89,6 л
Ответ: V(CO2) = 89,6 л
mр-р(CaCO3) = 500г
w(примеси) = 20 %
Найти:
V(CO2) - ?
Решение:
CaCO3 = CaO + CO2
w(CaCO3) = 100% - 20% = 80%
m(CaCO3) = 500 г * 0,8 = 400 г
n(CaCO3) = 400 г / 100 г/моль = 4 моль
n(CO2) = n(CaCO3) = 4 моль
V(CO2) = 4 моль * 22,4 л/моль = 89,6 л
Ответ: V(CO2) = 89,6 л
Приложения:
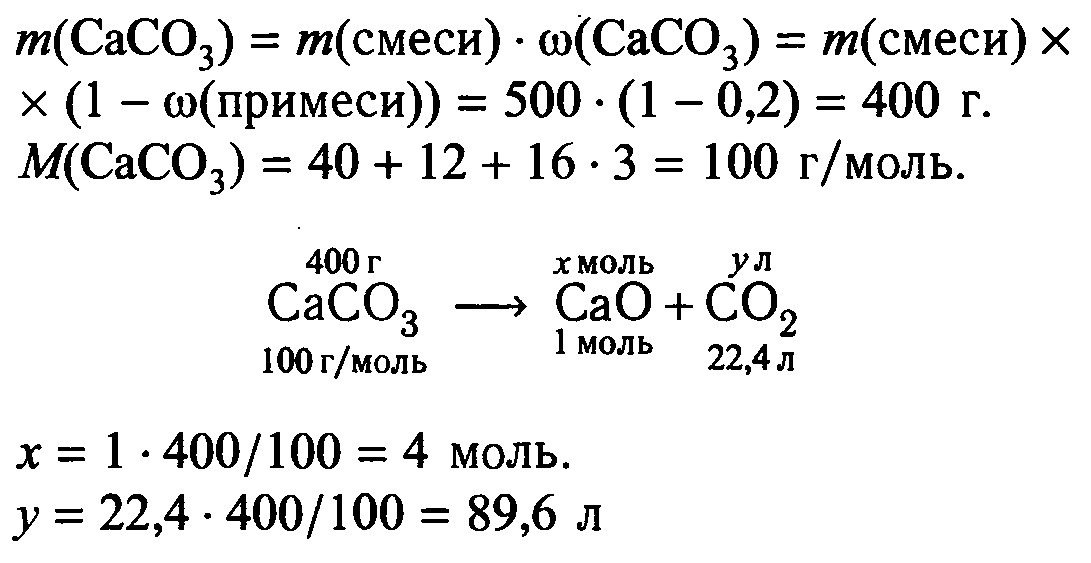
Похожие вопросы
Предмет: Биология,
автор: fwefew2
Предмет: Другие предметы,
автор: Аноним
Предмет: Математика,
автор: cxmeteryy
Предмет: Информатика,
автор: ВЕЛИКАЯ22
Предмет: Экономика,
автор: telenok31