Предмет: Химия,
автор: wantedie
Определите направление смещения равновесия в системе
СOCl2(г) ↔CO(г)+ Cl2(г) , ∆Н^0>0 при:
а) повышении температуры; б) увеличении концентрации свободного хлора?
Приложения:
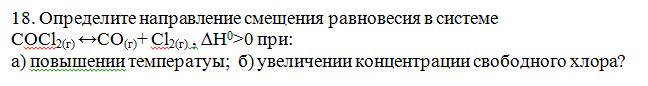
Ответы
Автор ответа:
1
Направление сдвига химического равновесия определяется принципом Ле-Шателье: если на систему в состоянии истинного равновесия воздействовать извне, изменяя термодинамические параметры, то равновесие сместится в том направлении, которое ослабит эффект внешнего воздействия.
СOCl2(г) ↔CO(г)+ Cl2(г) , ∆Н^0>0
а) Реакция является эндотермической, поэтому повышении температуры смещает химическое равновесие в сторону продуктов реакции (CO(г)+ Cl2(г)),
б) Увеличении концентрации свободного хлора смещает химическое равновесие в сторону исходного вещества (СOCl2).
СOCl2(г) ↔CO(г)+ Cl2(г) , ∆Н^0>0
а) Реакция является эндотермической, поэтому повышении температуры смещает химическое равновесие в сторону продуктов реакции (CO(г)+ Cl2(г)),
б) Увеличении концентрации свободного хлора смещает химическое равновесие в сторону исходного вещества (СOCl2).
wantedie:
Спасибо большое , направления в случаях а и б были , но хотел увидеть объяснения
Вы это сделали
Пожалуйста)))
Похожие вопросы
Предмет: География,
автор: emirshekerbekov2009
Предмет: Физика,
автор: bersiksasha6
Предмет: Другие предметы,
автор: zenadragun953
Предмет: Геометрия,
автор: iltsthpvj
Предмет: Математика,
автор: annaemelina45