Предмет: Химия,
автор: Фупошлячка
при взаимодействии смеси порошков железа и цинка массой 6,05 г с избытком раствора хлорида меди (II), образовалась металлическая медь массой 6,4 г. Определите количественный состав исходной смеси
PS решение нужно НЕ через функцию. Если такое возможно, конечно.
Ответы
Автор ответа:
0
Ответ на данную задачу см в приложении.
n(Fe) = 3.2/56=0,057моль
n(Zn) = 2.85/65 = 0,044 моль
Ответ: количество в-ва железа 0,057 моль; а цинка - 0,044 моль
В решении задачи: Примем массу железа за х г, а массу меди, которая выделится в реакции за у г, тогда масса цинка будет (6,05-х) г, а масса выделившейся в реакции меди - (6,4 - у) г.
Составляем уравнения реакций.
Затем - составляем систему двух уравнений.
n(Fe) = 3.2/56=0,057моль
n(Zn) = 2.85/65 = 0,044 моль
Ответ: количество в-ва железа 0,057 моль; а цинка - 0,044 моль
В решении задачи: Примем массу железа за х г, а массу меди, которая выделится в реакции за у г, тогда масса цинка будет (6,05-х) г, а масса выделившейся в реакции меди - (6,4 - у) г.
Составляем уравнения реакций.
Затем - составляем систему двух уравнений.
Приложения:
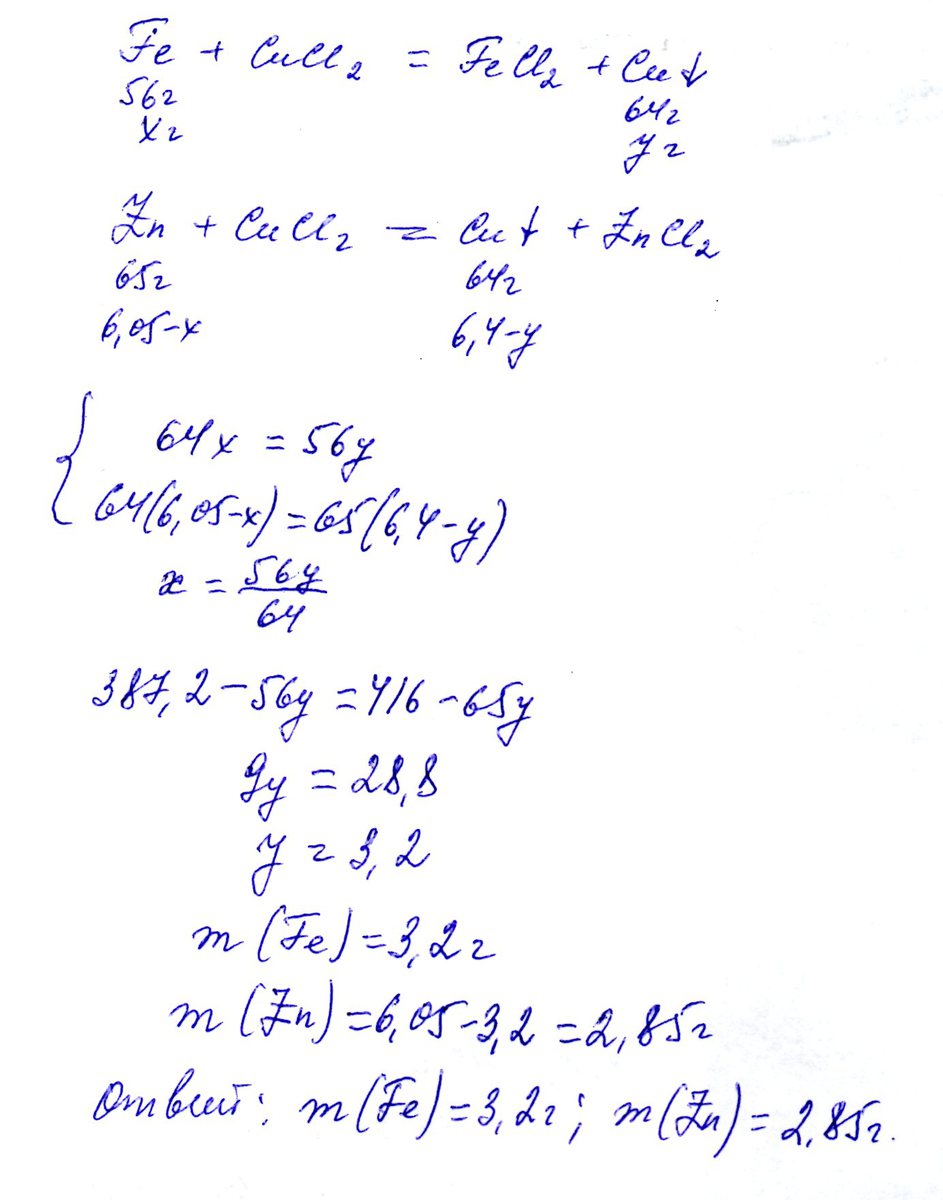
Похожие вопросы
Предмет: Английский язык,
автор: gigi5248
Предмет: Физика,
автор: nastyak12119
Предмет: Қазақ тiлi,
автор: aishaabish269
Предмет: Биология,
автор: kate3002
Предмет: Математика,
автор: tanusha8282