Предмет: Химия,
автор: Аноним
Упражнение по ОВР (окислительно-восстановительные реакции)
Можно любой вариант.
Приложения:
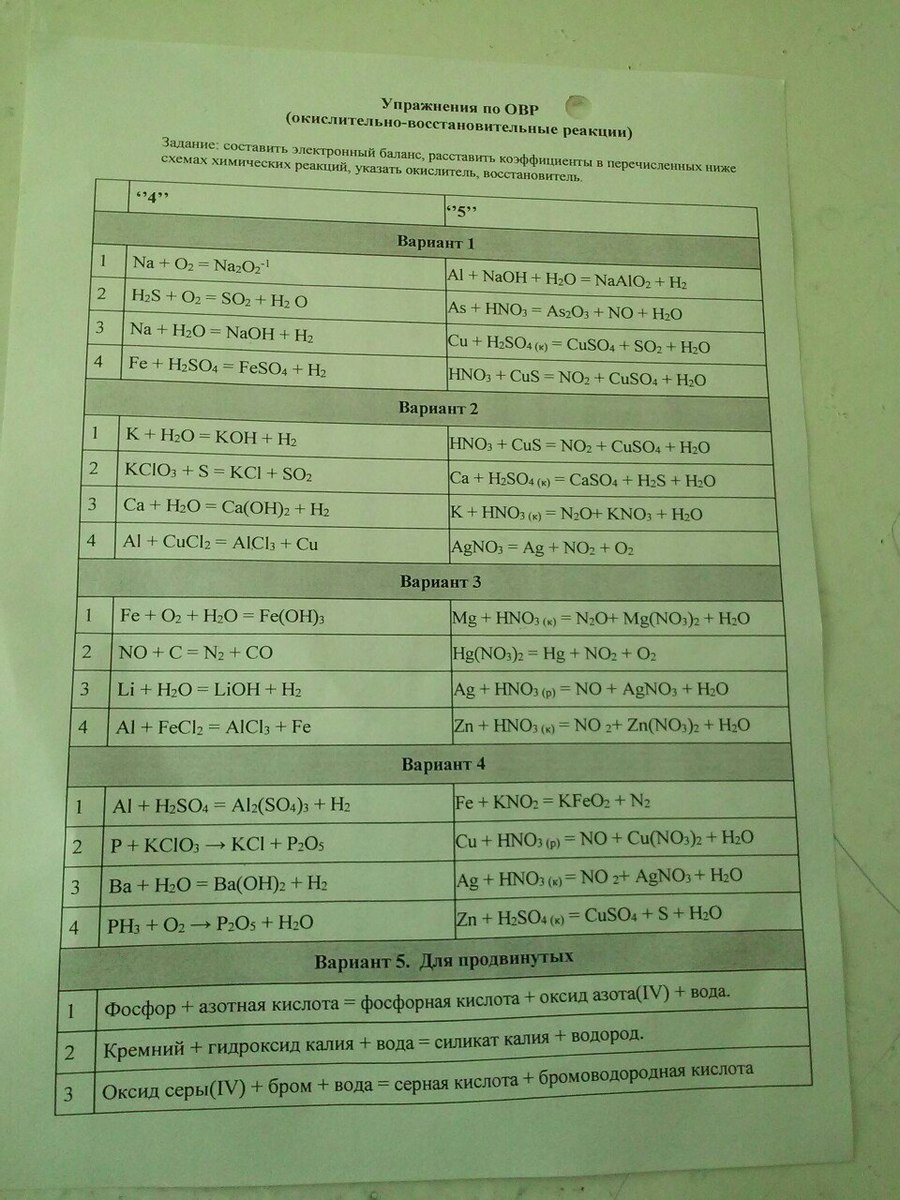
Ответы
Автор ответа:
0
Вариант 2
1) K⁰ + H₂⁺O →K⁺OH + H₂⁰
K⁰ - e⁻→ K⁺ восстановитель, процесс окисления
H⁺ + e⁻ → H⁰ окислитель, процесс восстановления
2K + 2H₂O = 2KOH + H₂
2) KCI⁺⁵O₃ + S⁰ → KCI⁻ + S⁺⁴O₂
CI⁺⁵ +6e⁻ → CI⁻ 6 2 окислитель, процесс восстановления
12
S⁰ - 4e⁻→ S⁺⁴ 4 3 восстановитель, процесс окисления
2KCIO₃ + 3S = 2KCI + 3SO₂
3) Ca⁰ + H₂⁺O → Ca⁺²(OH)₂ + H₂⁰
Ca⁰ - 2e⁻ → Ca⁺² 2 1восстановитель, процесс окисления
2
H⁺ +e⁻ → H⁰ 1 2 окислитель, процесс восстановления
Ca + 2H₂O = Ca(OH)₂ + H₂
4) AI⁰ + Cu⁺²CI₂ → AI⁺³CI₃ + Cu⁰
AI⁰ -3e⁻ → AI⁺³ 3 2восстановитель, процесс окисления
6
Cu⁺² +2e⁻ →Cu⁰ 2 3 окислитель, процесс восстановления
2AI + 3CuCI₂ = 2AICI₃ + 3Cu
на "5"
1)
HN⁺⁵O₃ + CuS⁻² → N⁺⁴O₂ +CuS⁺⁶O₄ + H₂O
N⁺⁵ +1e⁻ → N⁺⁴ 1 8 окислитель, процесс восстановления
8
S⁻² - 8e⁻→ S⁺⁶ 8 1 восстановитель, процесс окисления
8HNO₃ + CuS = 8NO₂ + CuSO₄ + 4H₂O
2) Ca⁰ + H₂S⁺⁶O₄(к) → Ca⁺²SO₄ + H₂S⁻² + H₂O
Ca⁰ -2e⁻ → Ca⁺² 2 4восстановитель, процесс окисления
8
S⁺⁶ +8e⁻ → S⁻² 8 1окислитель, процесс восстановления
4Ca + 5H₂SO₄(к) = 4CaSO₄ + H₂S + 4H₂O
3) K⁰ + HN⁺⁵O₃(к) →N⁻³H₄NO₃ + K⁺NO₃ + H₂O
K⁰ - e⁻ → K⁺ 1 8 восстановитель, процесс окисления
8
N⁺⁵ + 8e⁻ → N⁻³ 8 1окислитель, процесс восстановления
8K + 10HNO₃(к) = N⁻³H₄NO₃ + 8K⁺NO₃ + 3H₂O
4) Ag⁺N⁺⁵O₃⁻² →Ag⁰ + N⁺⁴O₂ + O₂⁰
Ag⁺ + e⁻ →Ag⁰ 1
N⁺⁵ + e⁻ → N⁺⁴ 1 1 окислители, процесс восстановления
2
O₃⁻² - 2e⁻ → O₂⁰ 2 1 восстановитель, процесс окисления
2AgNO₃ = 2Ag + 2NO₂ + O₂
1) K⁰ + H₂⁺O →K⁺OH + H₂⁰
K⁰ - e⁻→ K⁺ восстановитель, процесс окисления
H⁺ + e⁻ → H⁰ окислитель, процесс восстановления
2K + 2H₂O = 2KOH + H₂
2) KCI⁺⁵O₃ + S⁰ → KCI⁻ + S⁺⁴O₂
CI⁺⁵ +6e⁻ → CI⁻ 6 2 окислитель, процесс восстановления
12
S⁰ - 4e⁻→ S⁺⁴ 4 3 восстановитель, процесс окисления
2KCIO₃ + 3S = 2KCI + 3SO₂
3) Ca⁰ + H₂⁺O → Ca⁺²(OH)₂ + H₂⁰
Ca⁰ - 2e⁻ → Ca⁺² 2 1восстановитель, процесс окисления
2
H⁺ +e⁻ → H⁰ 1 2 окислитель, процесс восстановления
Ca + 2H₂O = Ca(OH)₂ + H₂
4) AI⁰ + Cu⁺²CI₂ → AI⁺³CI₃ + Cu⁰
AI⁰ -3e⁻ → AI⁺³ 3 2восстановитель, процесс окисления
6
Cu⁺² +2e⁻ →Cu⁰ 2 3 окислитель, процесс восстановления
2AI + 3CuCI₂ = 2AICI₃ + 3Cu
на "5"
1)
HN⁺⁵O₃ + CuS⁻² → N⁺⁴O₂ +CuS⁺⁶O₄ + H₂O
N⁺⁵ +1e⁻ → N⁺⁴ 1 8 окислитель, процесс восстановления
8
S⁻² - 8e⁻→ S⁺⁶ 8 1 восстановитель, процесс окисления
8HNO₃ + CuS = 8NO₂ + CuSO₄ + 4H₂O
2) Ca⁰ + H₂S⁺⁶O₄(к) → Ca⁺²SO₄ + H₂S⁻² + H₂O
Ca⁰ -2e⁻ → Ca⁺² 2 4восстановитель, процесс окисления
8
S⁺⁶ +8e⁻ → S⁻² 8 1окислитель, процесс восстановления
4Ca + 5H₂SO₄(к) = 4CaSO₄ + H₂S + 4H₂O
3) K⁰ + HN⁺⁵O₃(к) →N⁻³H₄NO₃ + K⁺NO₃ + H₂O
K⁰ - e⁻ → K⁺ 1 8 восстановитель, процесс окисления
8
N⁺⁵ + 8e⁻ → N⁻³ 8 1окислитель, процесс восстановления
8K + 10HNO₃(к) = N⁻³H₄NO₃ + 8K⁺NO₃ + 3H₂O
4) Ag⁺N⁺⁵O₃⁻² →Ag⁰ + N⁺⁴O₂ + O₂⁰
Ag⁺ + e⁻ →Ag⁰ 1
N⁺⁵ + e⁻ → N⁺⁴ 1 1 окислители, процесс восстановления
2
O₃⁻² - 2e⁻ → O₂⁰ 2 1 восстановитель, процесс окисления
2AgNO₃ = 2Ag + 2NO₂ + O₂
Похожие вопросы
Предмет: Литература,
автор: fass16
Предмет: Геометрия,
автор: severreflect
Предмет: Французский язык,
автор: Xmpuququq
Предмет: История,
автор: simpatia991
Предмет: География,
автор: kiratokmacheva