Предмет: Химия,
автор: pavellevshic
Найдите массу раствора гидроксида калия с массовой долей щелочи 4% потребовавшегося для реакции с углекислым газом, если в результате образовалась средняя соль массой 27,6 г.
Ответы
Автор ответа:
46
2KOH + CO2 = K2CO3 + H2O
M(K2CO3)=138 г/моль
n(K2CO3)=27,6/138=0,2 моль
n(KOH):n(K2CO3)=2:1, отсюда n(KOH)=2х0,2=0,4 моль
M(KOH)=56 г/моль
m(KOH)=56х0,4=22,4 г
m(р-ра)=22,4х100/4=560 г
M(K2CO3)=138 г/моль
n(K2CO3)=27,6/138=0,2 моль
n(KOH):n(K2CO3)=2:1, отсюда n(KOH)=2х0,2=0,4 моль
M(KOH)=56 г/моль
m(KOH)=56х0,4=22,4 г
m(р-ра)=22,4х100/4=560 г
pavellevshic:
спасибо за решение
Автор ответа:
18
....................
Приложения:
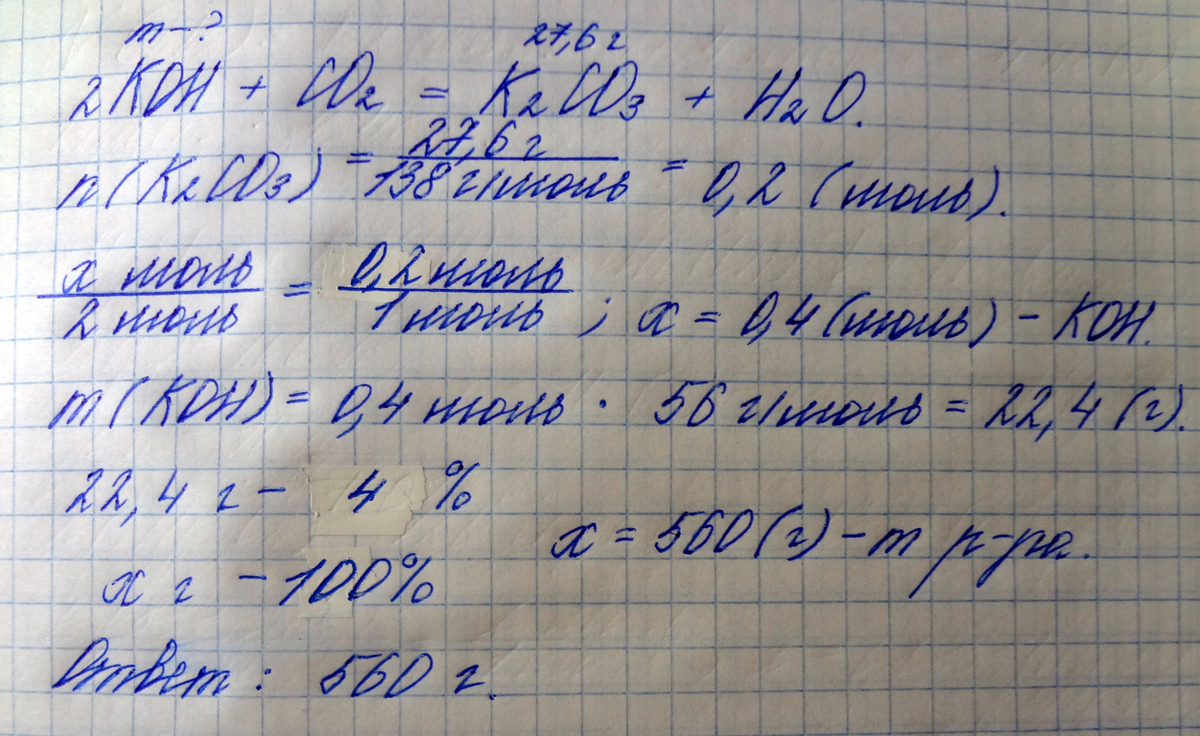
пасиб
=)
Похожие вопросы
Предмет: Українська мова,
автор: урган1
Предмет: Русский язык,
автор: MasterFm
Предмет: Українська мова,
автор: milas15082008
Предмет: Физика,
автор: PickUser
Предмет: Математика,
автор: Viktorija11111