Предмет: Химия,
автор: Лексия
пожалуйста, объяснить по-тупому, как определять количество электронов, отданных или принятых в электронном балансе?
Я знаю, как расставлять знаки в простых уравнениях, где нету коэффициентов , таких как:
Mg+S=MgS
вост.|Mg-2e=Mq|окис.
окис.|S+2e=S|вост.
А как быть с уравнениями вида:
Mg+H2O=MgO+H2?
Как в этом случае расставлять кол. электронов в электроном балансе? Я не понимаю, куда девать коэффициенты ?
Лексия:
Желательно, на листочке расписать и показать :C
Ответы
Автор ответа:
1
смотри, если с решенного не поймёшь, попытаюсь объяснить
Приложения:

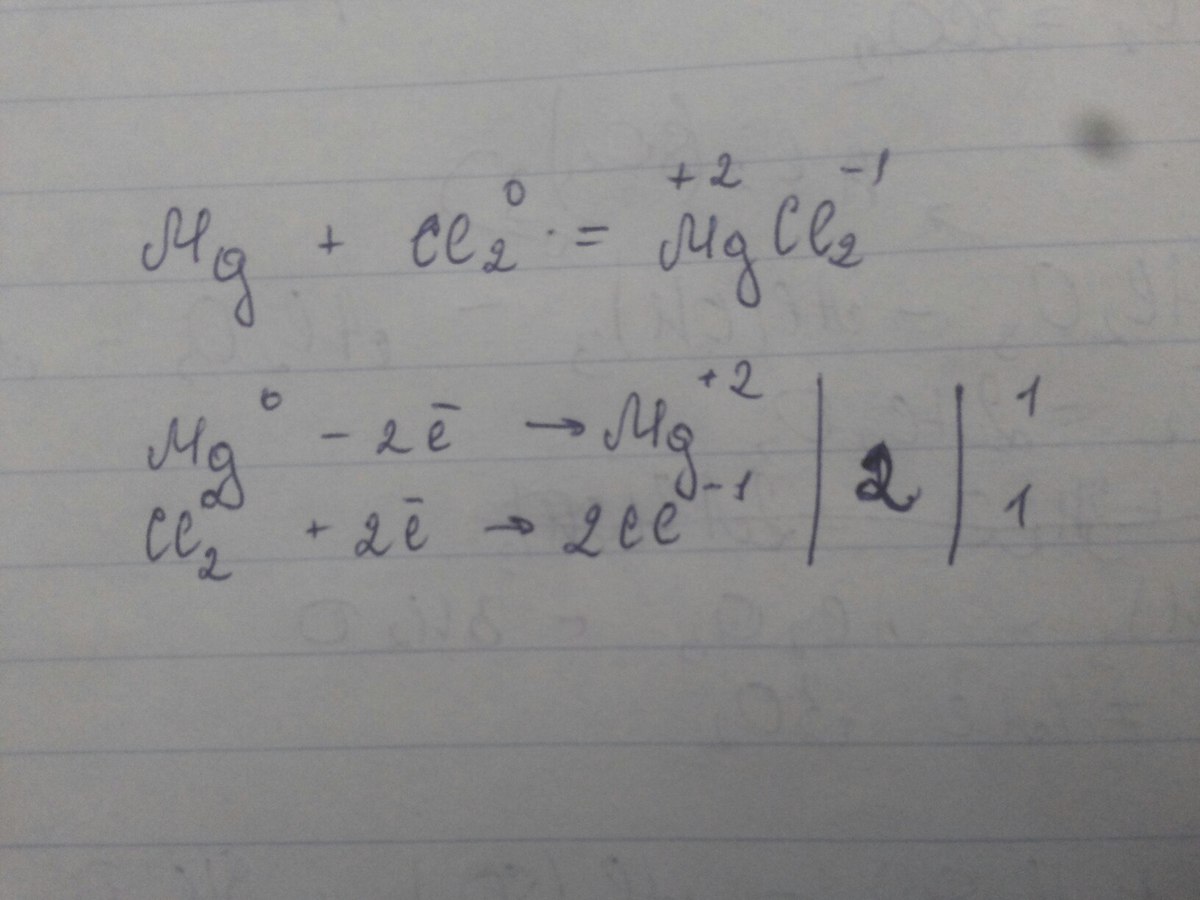
Вот эту вот фигню я и не могу никак понять
Умножаем двойку перед Н на 1 (его электрон) и получается 2, и до нуля нам не хватает 2 электрона, пишем +2е
А двойка перед Н взялась потому что Н2О, у О 2 валентность ставим 2 к Н
т.е в других случаях, мы также перемножаем коэффициент на степень окисления?
если у меня будет коэффициент 5, а степень окисления 2, то до нуля мне не будет хватать 10 e?
а "2" справа у H? Она не считается? На неё не смотреть?
По идее да, все так, 10е и двойка справа не считается, и я ещё пример скинул, там у Сl 2 умножаем на - 1
А что обозначает большая двойка и 2 маленькие единички справа?
Это перед тем как расставлять коэффициенты, можно найти наименьшее общее кратное, в нашем случае это 2, делим и получается по 1, и можно расставлять единицы, нас тип так учили
Спасибо большое!
Похожие вопросы
Предмет: Русский язык,
автор: nik848
Предмет: Русский язык,
автор: Erke1semey
Предмет: Русский язык,
автор: 19283746521
Предмет: Английский язык,
автор: yana6622