Предмет: Химия,
автор: h321822
На 150 гр известняка, содержащего 90 % CaCo3, подействовали избытком соляной кислоты. Вычислите кол-во вещества, объем (н.у) и массу выделившегося газа
Ответы
Автор ответа:
3
Решение в файле
................
Приложения:
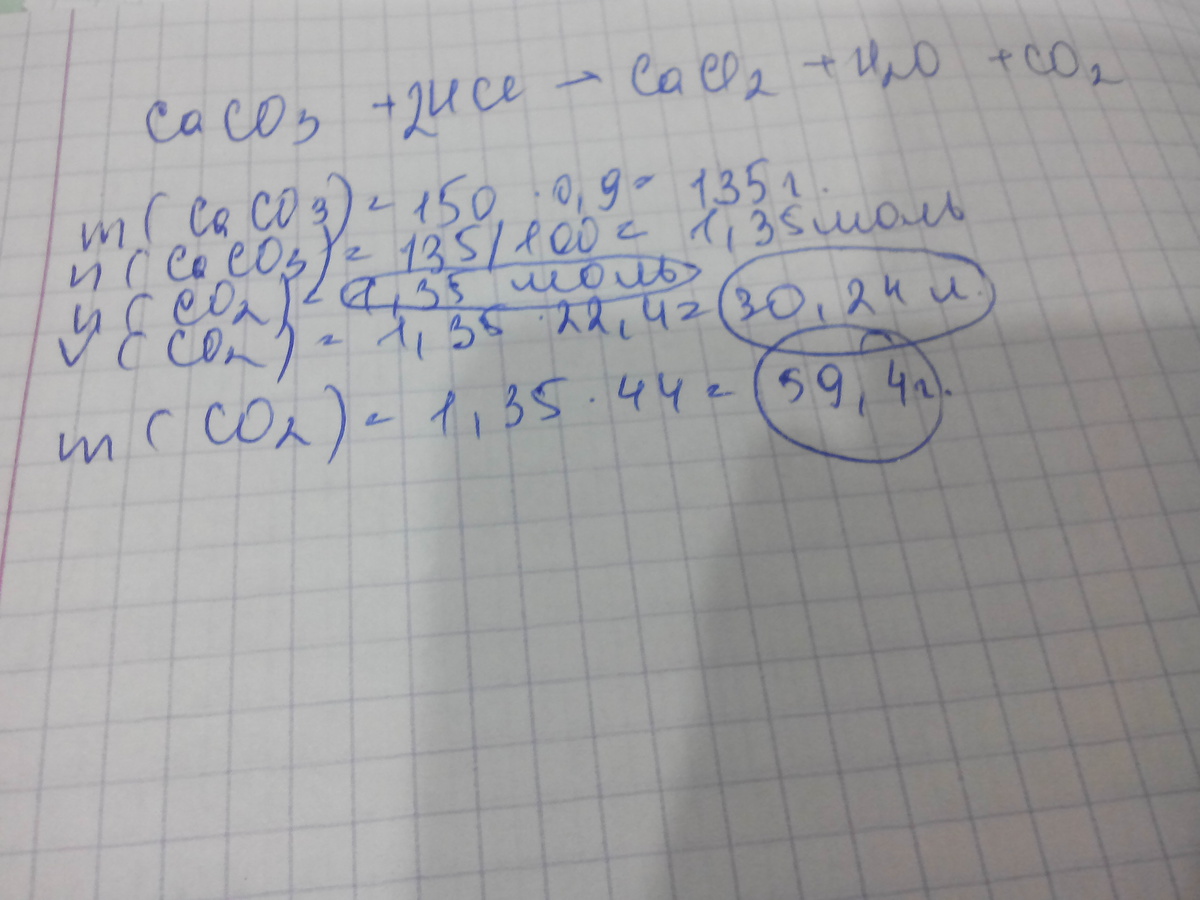
Автор ответа:
1
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
найдем массу чистого известняка (CaCO3)
150 г - 100%
х г - 90%
m(чист. CaCO3)= 135 г
n(CaCO3)=m/M = 135 / 100= 1,35 моль
n(CO2)=n(CaCO3)
V(CO2)=n*Vm = 1,35 * 22,4= 30,24 л
m(CO2) = n*M = 1.35 * 44 = 59,4 г
найдем массу чистого известняка (CaCO3)
150 г - 100%
х г - 90%
m(чист. CaCO3)= 135 г
n(CaCO3)=m/M = 135 / 100= 1,35 моль
n(CO2)=n(CaCO3)
V(CO2)=n*Vm = 1,35 * 22,4= 30,24 л
m(CO2) = n*M = 1.35 * 44 = 59,4 г
Похожие вопросы
Предмет: Українська мова,
автор: Vika36136
Предмет: Русский язык,
автор: 197839
Предмет: Английский язык,
автор: ShimanoKazetto
Предмет: Информатика,
автор: Doni20044
Предмет: Математика,
автор: Dobraya001